作者:微生态
编译:微科盟阿默,编辑:微科盟居居、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。
导读
作为一种新兴的食物纳米污染物,食源性碳点(CDs)是哺乳动物代谢毒性的一个日益增加的风险因素。本研究报道了慢性CDs暴露通过破坏小鼠的肠-肝轴引起糖代谢障碍。16s rRNA分析表明,CDs暴露降低了有益菌(拟杆菌、粪球菌和S24-7)的丰度,增加了有害菌(变形菌门、Oscillospira、脱硫弧菌科和瘤胃球菌科)的丰度,同时增加了厚壁菌门/拟杆菌门的比率。从机制分析可知,增加的促炎细菌释放内毒素脂多糖,诱导肠道炎症以及肠黏液层破坏,进而通过TLR4/NFκB/MAPK信号通路激活小鼠全身炎症并诱导肝脏胰岛素抵抗。此外,益生菌几乎能够完全逆转这些变化。从CDs暴露小鼠中移植的粪便菌群能够诱导受体小鼠葡萄糖耐受不良、肝功能受损、肠黏液层损伤、肝脏炎症和胰岛素抵抗。然而,暴露于CDs的微生物群耗竭小鼠体内的这些生物标志物都处于正常水平,与微生物群耗竭的对照小鼠一致,这表明肠道菌群失调有助于CDs诱导的炎症介导的胰岛素抵抗。综上所述,本研究结果揭示了肠道菌群失调有助于CDs诱导的炎症介导的胰岛素抵抗,并试图阐明具体的潜在机制。此外,还强调了评估与食源性CDs相关危害的重要性。
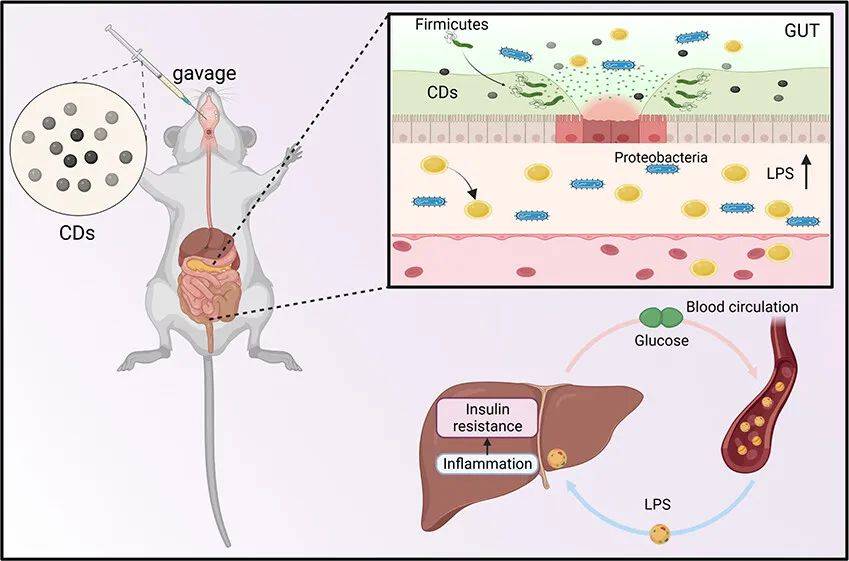
图文摘要
论文ID
原名:Foodborne carbon dot exposure induces insulin resistance through gut microbiota dysbiosis and damaged intestinal mucus layer
译名:食源性碳点暴露通过肠道菌群失调和肠道黏液层损伤诱导胰岛素抵抗
期刊:ACS Nano
IF:18.027
发表时间:2023.3.10
通讯作者:顾宁
通讯作者单位:哈尔滨工业大学生命科学与技术学院
DOI号:10.1021/acsnano.3c01005
实验设计
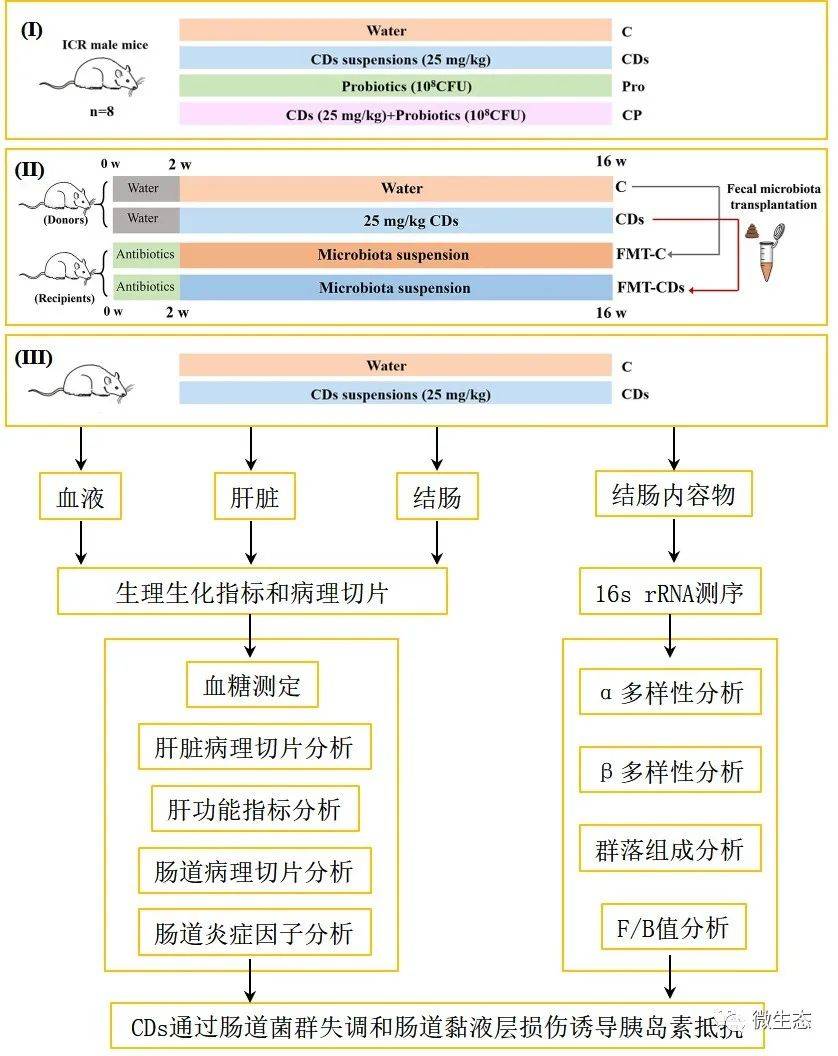
结果与讨论
1 CDs引起葡萄糖稳态失衡和肝损伤,这可通过补充益生菌缓解
肠道菌群的改变与纳米颗粒诱导的代谢综合征有关,特别是葡萄糖代谢。由于有机成分碳化,加热时可产生食源性CDs,由于不可避免地摄入日常食品,CDs可能对健康造成不利影响。越来越多的证据表明摄入的CDs被内化,从而触发ROS过量、氧化应激、炎症和细胞凋亡。啤酒是世界上消费量最大的酒精饮料,长期饮用啤酒与2型糖尿病密切相关。之前的研究已经证实了啤酒中普遍存在CDs。然而,很少有研究关注不可避免的啤酒源CDs的暴露与由肠道微生物群介导的糖代谢紊乱之间的关系。由于肠道与多个器官(如肠-肝、肠-脑和肠-肺轴)之间的新联系,我们推测口服啤酒性CDs能够通过肠-肝轴诱导葡萄糖稳态失衡。
本研究使用D101大孔树脂柱从自酿啤酒中提取CDs,并通过透射电子显微镜(TEM)表征其纳米结构(补充图1),用于进一步的动物实验。为了探索CDs对葡萄糖代谢和肠道菌群的影响,我们建立了慢性CDs暴露的小鼠模型,同时作为对比,我们设置了益生菌补充组。越来越多的证据表明,几种肠道细菌有利于改善2型糖尿病,如双歧杆菌(Bifidobacterium)、乳杆菌(Lactobacillus)、芽孢杆菌(Bacillus)、嗜热链球菌(Streptococcus thermophilus)和阿克曼氏菌(Akkermansia),它们可以作为益生菌使用。在本研究中,我们选择VSL#3作为益生菌补充剂,该益生菌已在肠道炎症的动物模型中进行了广泛的研究和测试,并且含有高浓度(4500亿菌落/袋)活的、冻干的双歧杆菌、乳杆菌和嗜热芽孢杆菌混合物。图1a所示为用CDs处理的小鼠。CDs暴露14周后,小鼠出现高空腹血糖水平(图1b),空腹体重不变(图1c),糖耐量受损(图1d和e),这表明葡萄糖稳态受到干扰。与CDs小鼠相比,CDs和益生菌共暴露组(CP)的小鼠表现出正常的葡萄糖稳态,表明益生菌对CDs的糖代谢毒性具有保护作用。鉴于肝脏是葡萄糖代谢的重要器官,我们探讨了CDs对小鼠肝脏的损伤作用和益生菌的保护作用。如图1f和g所示,CDs暴露组小鼠的肝脏重量和指数均有所增加,但是补充益生菌后恢复正常。与空白组(C)小鼠相比,CDs暴露组小鼠肝脏的苏木精-伊红(H&E)染色显示肝脏脂肪变性增加、肝细胞空泡增多、肝纤维化锁破裂,而CP组小鼠肝脏形态正常(图1h)。天冬氨酸转氨酶(AST)和谷丙转氨酶(ALT)是反映肝功能的重要生物标志物,如图1i−l所示,CDs增加了小鼠血清和肝脏中的AST和ALT水平,而CP组补充益生菌后可恢复这些指标。这些结果表明,CDs破坏了葡萄糖稳态、引起肝损伤,而补充益生菌可恢复这些损伤。
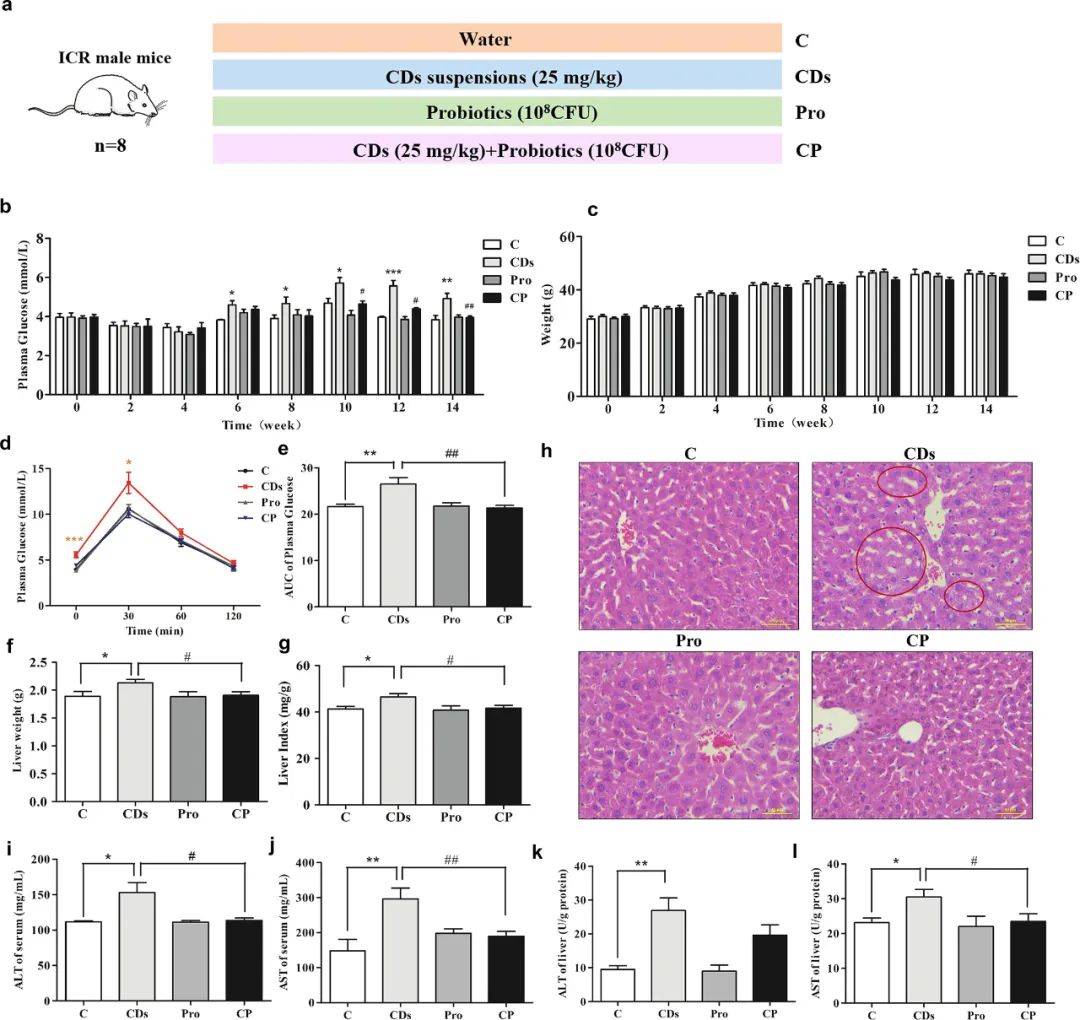
图1. CDs暴露对葡萄糖稳态和肝功能的影响以及复合益生菌的有益作用。
(a)实验设计示意图;(b)空腹血糖;(c)空腹体重;(d) OGTT及(e) OGTT的AUC;(f)肝脏重量;(g)肝脏指数;(h)小鼠肝脏切片H&E染色图像(200×);(i−l)血清和肝脏中AST和ALT的水平。*p < 0.05 vs C组,**p < 0.01 vs C组,***p < 0.001 vs C组,#p < 0.05 vs CD组,##p < 0.01 vs CD组。结果为平均值±SE (n = 8)。
2CDs引起肠道菌群失调,通过补充益生菌得以恢复
目前的研究表明,肠道菌群在饮食诱导的2型糖尿病中起着重要作用。为了探究CDs对肠道菌群的影响,我们利用小鼠结肠内容物进行了16s rRNA基因测序。CDs对肠道菌群的影响体现在三组间菌群多样性和结构的差异上(补充图2a - c)。在人类中,与健康人群相比,2型糖尿病患者普遍存在肠道菌群α-多样性低的现象。在本研究中,CDs暴露导致小鼠肠道微生物群α-多样性指数(包括Chao1、Simpson、Shannon指数、观察物种和Pielou-e)低于对照组小鼠,而益生菌处理后几乎恢复正常(图2a)。此外,与C组相比,CDs暴露组小鼠的β-多样性差异点显示出了明显的菌群组成差异,益生菌处理的小鼠与CDs暴露组小鼠部分分开,但与C小鼠相似,表明益生菌肠道微生物谱发生了正向变化(图2b和c)。维恩图显示各组间共有和非共有操作分类单元(OTUs)的数量,并显示不同的物种组成(图2d)。C组和CDs组之间的稀疏曲线、组间差异、OTU丰度也存在明显差异,但通过补充益生菌几乎可以恢复(补充图2a-d)。进一步分析显示,与C组和CDs组相比,肠道菌群组成从门到属水平发生了广泛变化(图2e-g,补充图2e-g)。在门水平上,CDs暴露组小鼠体内微生物(如拟杆菌丰度降低,F:B比值增加,变形菌丰度增加,粪球菌丰度降低)的改变与系统炎症或代谢综合征相关(图2h−k)。拟杆菌能改善炎症并有益于代谢功能障碍。CDs还使F:B的比值增加了2倍以上,F:B比值是饮食诱导代谢紊乱(肥胖、高血糖和IR)的肠道微生物标志。瘤胃球菌科属于厚壁菌门,具有炎症活性,在妊娠糖尿病妇女中大量存在。拟杆菌目科S24-7能够改善代谢综合征患者的生理功能。在本研究中,CDs组中瘤胃球菌科丰度较高,S24-7丰度较低(图2l,m,补充图2h,i)。更值得注意的是,口服CDs增加了能够产生硫化氢(H2S)和脂多糖(LPS)的硫酸盐还原细菌的相对丰度(图3a和b),它与其他肠道细菌相比具有1000倍的内毒素活性,这已被证实是全身炎症的驱动因素。多项研究表明,个体的慢性全身性炎症可能有助于2型糖尿病的发展。值得注意的是,所有CDs引起的微生物群组成的改变都可以通过膳食益生菌恢复。
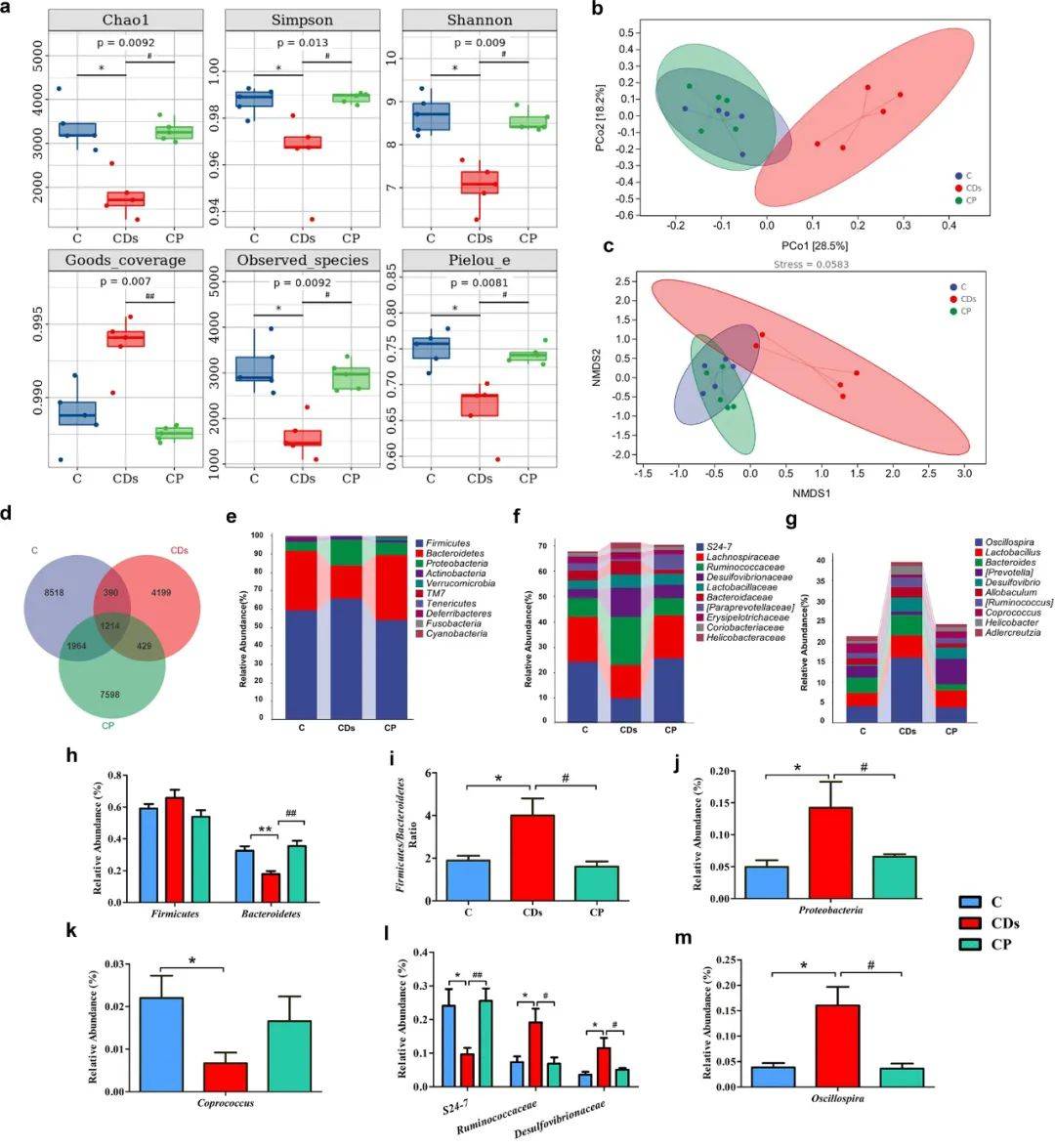
图2. CDs暴露对肠道菌群的影响以及复合益生菌的有益作用。
(a) α-多样性指数;(b, c) C、CD、CP组间的主坐标分析(PCoA),每个点代表一个样本;(d)维恩图;(e-g)肠道菌群在门、科和属水平上的相对丰度;(h)厚壁菌门和拟杆菌门的相对丰度;(i)厚壁菌门/拟杆菌门比值;(j)变形菌门相对丰度;(l)粪球菌的相对丰度;(m) S24-7、Ruminococcaceae和Desulfovibrionaceae的相对丰度;(n) Oscillospira的相对丰度。*p < 0.05 vs C组,**p < 0.01 vs C组,#p < 0.05 vs CD组,##p < 0.01 vs CD组。结果为平均值±SE (n = 5)。
3CDs诱导的肠道菌群失调增加了肠道通透性并引起了脂多糖相关的系统炎症
肠黏液层是肠屏障的重要组成部分,是黏液蛋白形成的糖基化水合凝胶,是肠上皮和内容物之间的屏障,能够防止外源颗粒和微生物与肠道上皮接触。肠道细菌利用黏液来源的营养物质在黏液层定植并与其相互作用。一般来说,肠道内LPS含量的增加会引起肠道炎症反应和氧化应激,改变肠上皮细胞(IECs)的极性,降低IECs之间紧密连接蛋白的表达,促进IECs的凋亡,导致肠黏液层损伤和LPS的转运。在图3a和b中,分类差异和LEfSe分析表明,CDs暴露增加了脱硫弧菌科的丰度,这意味着LPS水平较高以及肠道黏液层的破坏。结肠长度和隐窝深度是评估肠道炎症的指标。在本研究中,益生菌可防止CDs诱导的结肠长度缩短,并导致一种隐窝深度恢复的强烈趋势,这表明肠道炎症的减弱(图3c-e)。Periodic acid-Schiff (PAS)染色,也称为糖原染色,常用于检测肠道粘液。如图3f所示,与C组和CP组相比,CDs诱导小鼠肠道中的粘蛋白比例降低。MUC2是主要的黏液蛋白,通过二硫键的连接形成肠黏液层的骨架。Occludin是肠屏障的重要膜蛋白,在IECs的紧密连接中起重要作用。如图3f和g所示,MUC2和occludin的免疫荧光和免疫印迹分析进一步证实了CDs暴露组小鼠肠道黏液层的破坏。此外,粪便中LPS和H2S水平的升高也证实了脱硫弧菌的负面作用(图3h和i)。为了进一步验证系统炎症的存在,我们测定了血清中LPS以及下游炎症细胞因子的水平。在CD组中,较高的血清LPS和TNFα与LPS易位和全身炎症相关,但益生菌能够恢复这些症状(图3j,k)。基于这些结果,我们推测CDs诱导的微生物改变引起了肠道炎症、增加了肠道通透性,这在一定程度上可以通过益生菌恢复。
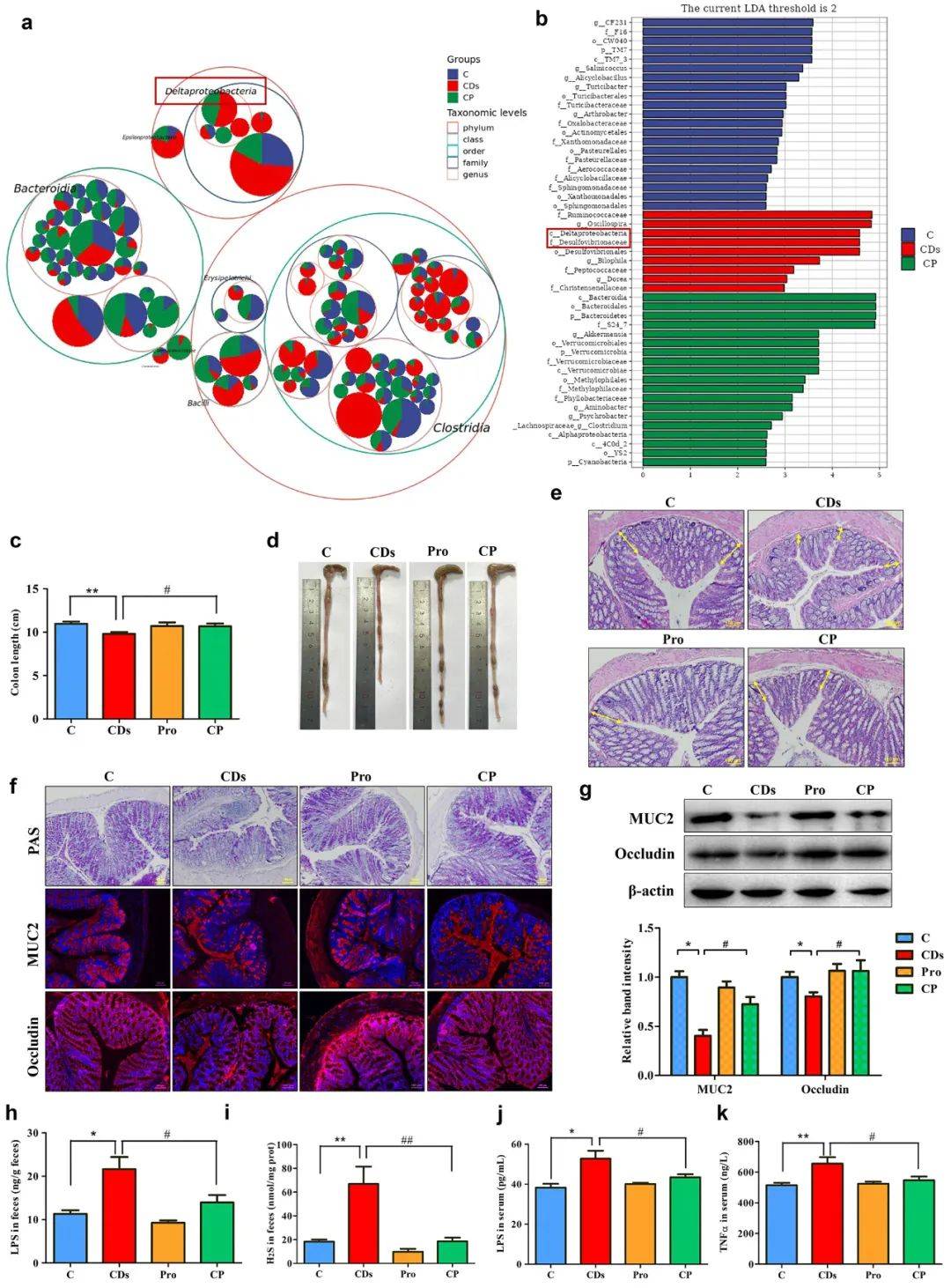
图3. CDs暴露对肠道黏液层和炎症的影响。
(a)基于16s rRNA序列的分类差异;(b)微生物群组成的LEfSe分析(LDA > 2, n = 5);(c, d)结肠长度;(e)结肠切片H&E染色;(f)结肠粘蛋白染色;(g) MUC2和occludin的Western分析;(h, i)粪便LPS和H2S检测;(j, k)血清LPS与炎性细胞因子检测。*p < 0.05 vs C组,**p < 0.05 vs C组,#p < 0.05 vs CD组,##p < 0.01 vs CD组。结果为平均值±SE (n = 8)。
4补充益生菌可恢复CDs介导的肝脏炎症和胰岛素抵抗
本研究还通过免疫印迹检测了肝脏蛋白的表达水平,这对于糖代谢障碍的发病机制至关重要。在免疫方面,LPS与TLR4结合,激活适配器MyD88,触发NF-κB和MAPK信号通路,从而增加促炎细胞因子的释放。在CDs组中,TLR4和MyD88表达水平升高,表明LPS转移到肝脏并激活相关免疫反应(图4a)。此外,CDs增加了IκB和p65-NFκB的磷酸化,促进了肝脏炎症,并通过磷酸化的JNK和p38进一步激活了丝裂原活化蛋白激酶(MAPK)级联(图4b和c)。有报道称,NF-κB和p38 MAPK信号通路的激活可触发胰岛素信号通路的阻断,从而导致肝脏糖异生的上调。如图4d所示,CDs降低AKT磷酸化,导致IR,进而促进FOXO1和PCKI,促进糖异生。然而,补充益生菌几乎使这些生物标志物恢复到正常水平。基于这些发现,我们推测CDs诱导的炎症和肝脏胰岛素抵抗依赖于肠道菌群。
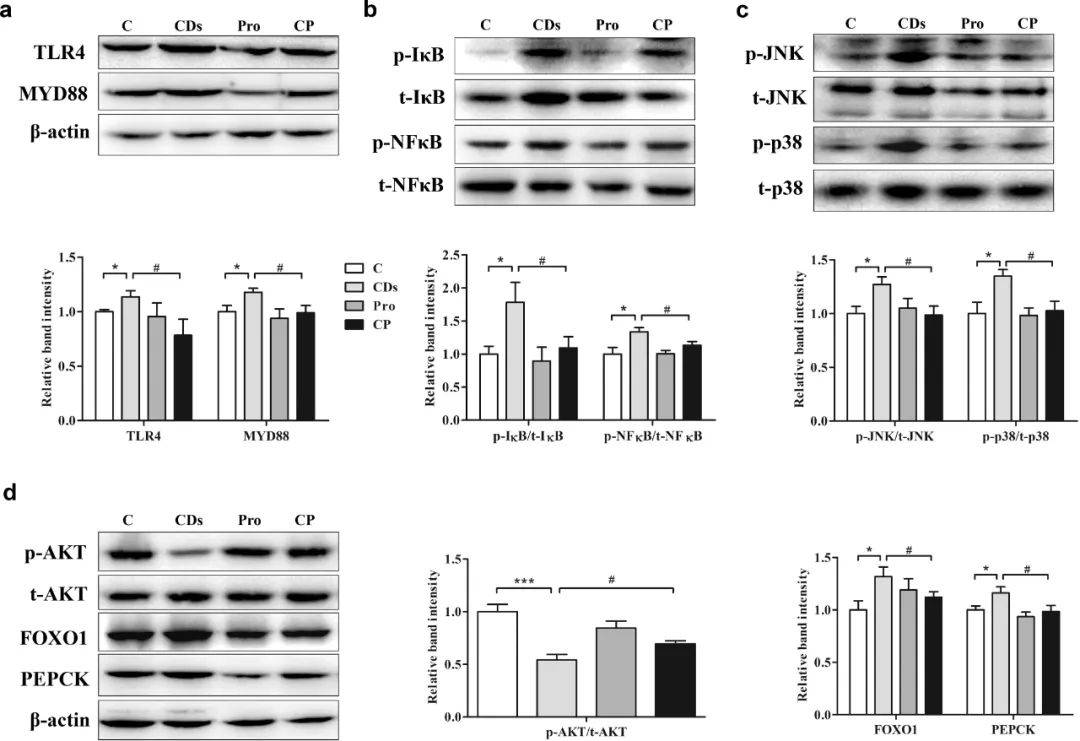
图4. CDs暴露对小鼠肝脏TLR4/NF-κB/MAPK和IR信号通路的影响。
(a) LR4/MyD88信号通路的Western分析;(b) NF-κB信号通路的Western分析;(c) p38 MAPK信号通路的Western分析;(d)葡萄糖代谢相关蛋白的Western分析。*p < 0.05 vs C组,***p < 0.001 vs C组,# p < 0.05 vs CD组。结果为平均值±SE (n = 8)。
5 CDs暴露小鼠的粪便菌群移植诱导受体小鼠葡萄糖稳态紊乱
这项研究支持了CDs通过改变肠道菌群来诱导小鼠胰岛素抵抗的假设。为此,我们进行了粪便菌群移植实验(图5a),该实验被认为是研究肠道菌群在疾病发展中的作用,同时保持对宿主遗传、饮食和环境等变量的控制的典型验证方法。在实验之前,我们用抗生素的混合物清洗了受体小鼠的原生微生物群。我们将CDs暴露组小鼠的肠道菌群移植到缺乏菌群的受体小鼠中(图5a)。与供体小鼠一致,FMT-CDs组小鼠的空腹血浆和葡萄糖耐受不良明显增加,而与FMT-C组相比,空腹体重没有变化(图5b-e)。接受CDs小鼠肠道菌群的受体小鼠表现出肝脏重量、肝脏指数、血清和肝脏的肝功能指标增加以及肝脏形态损伤的强烈趋势(图5f−l)。这些结果表明,糖代谢障碍和肝功能损伤随着肠道菌群转移到受体小鼠。
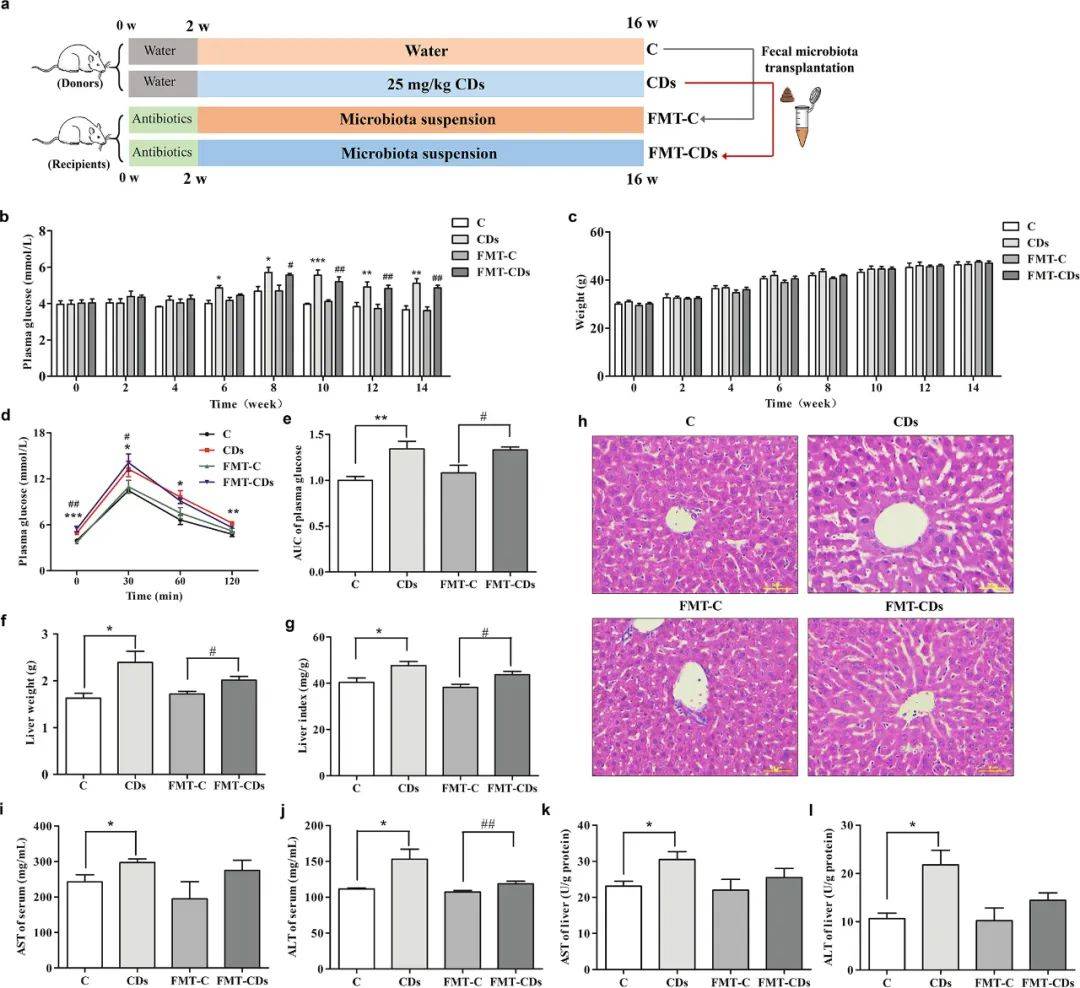
图5. CDs暴露小鼠的粪便菌群移植诱导受体小鼠葡萄糖稳态紊乱。
(a)实验设计示意图;(b)空腹血糖;(c)空腹体重;(d) OGTT及(e) OGTT的AUC;(f)肝脏重量;(g)肝脏指数;(h)小鼠肝脏切片H&E染色图像(200×);(i−l)血清和肝脏中AST和ALT的水平。*p < 0.05 vs C组,**p < 0.01 vs C组,***p < 0.001 vs C组,#p < 0.05 vs FMT-C组,##p < 0.01 vs FMT-C组。结果为平均值±SE (n = 8)。
6 CDs暴露小鼠的粪便菌群移植诱导肠道菌群失调和肠黏液层破坏,从而导致LPS易位并最终触发受体小鼠的胰岛素抵抗
接下来,我们通过16s rRNA测序研究了粪便菌群移植对小鼠肠道菌群的影响。测序结果显示,FMT-C组和FMT-CDs组的肠道菌群组成存在明显差异。来自CDs小鼠的粪便菌群移植有改变肠道菌群α-多样性的趋势,这与供体小鼠相似(图6a)。与β-多样性相关的PCoA显示FMT-CDs小鼠的肠道菌群与FMT-C分离(图6b和c)。肠道微生物组成分析也显示两组受体小鼠之间存在显著差异(图6d-f和补充图3)。在门水平上,FMT-CDs小鼠的菌群变化与CDs组高度一致,如厚壁菌门和变形菌门丰度增加,拟杆菌门丰度降低,F:B比值增加(图6g-j),这是饮食诱导代谢障碍的肠道微生物特征。同样,在科和属水平上,我们发现S24-7和脱硫弧菌科的丰度发生了变化,而这在FMT-C组中没有发生(图6k,l)。特别是脱硫弧菌科丰富度的增加导致粪便和血清中LPS水平升高。脂多糖被积极地运送到肝脏,在那里它激活炎症反应。与FMT-C小鼠相比,CDs小鼠的粪便菌群移植增加了受体小鼠的肠屏障通透性,以及与炎症相关的生物学指标水平(补充图4和图6m-s)。这些结果表明,被破坏的肠道黏液层和系统炎症随着肠道菌群转移到了受体小鼠。
通常,肠道来源的LPS运输到肝脏可以激活TLR4信号通路,从而引发炎症反应。正如预期的那样,图7a中的免疫印迹结果显示,与FMT-C相比,FMT-CD组TLR4和MYD88表达水平显著增加。然后,促进TLR4增强了炎症通路(NFκB和MAPK)(图7b,c),进一步导致胰岛素抵抗和糖异生(图7d)。这些结果表明,受体小鼠血糖相关分子通路的改变依赖于肠道菌群。
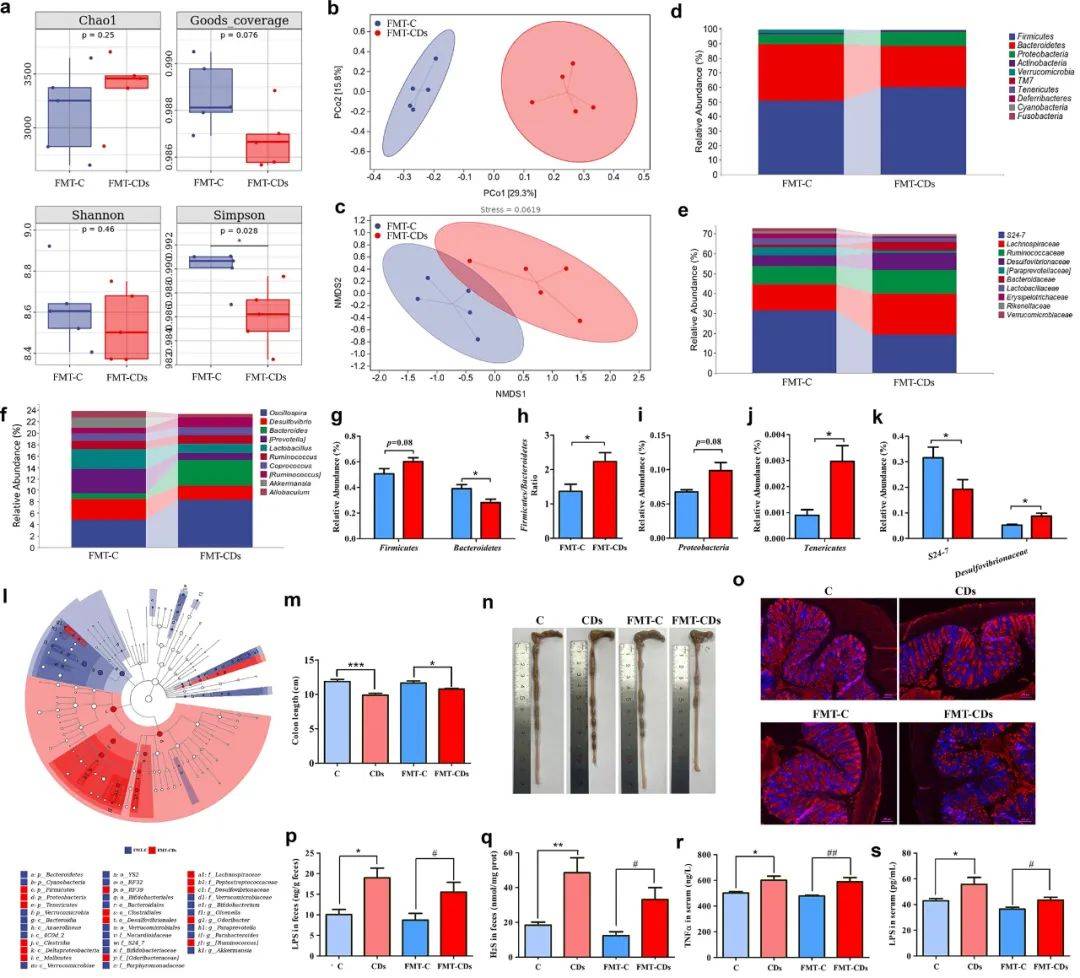
图6. CDs暴露小鼠的粪便菌群移植诱导肠道菌群失调、增加肠道通透性,并使受体小鼠的LPS转移。
(a) α多样性指数;(b, c)粪便菌群移植-C组和粪便菌群移植-CD组间的主坐标分析(PCoA);(d-f)在门、科和属水平上肠道菌群的相对丰度;(g)厚壁菌门和拟杆菌门的相对丰度;(h)厚壁菌门/拟杆菌门比值;(i)变形菌门的相对丰度;(j)软壁菌门的相对丰度;(k) S24-7和脱硫弧菌科的相对丰度;(l)微生物群组成的LEfSe分析(LDA > 2, n = 5);(m, n)结肠长度;(o)结肠粘蛋白染色;(p−q)粪便LPS和H2S检测;(r, s)血清LPS和炎症因子检测。*p < 0.05 vs C组,**p < 0.01 vs C组,***p < 0.001 vs C组,#p < 0.05 vs FMT-C组,##p < 0.01 vs FMT-C组。结果为平均值±SE (n = 5)。
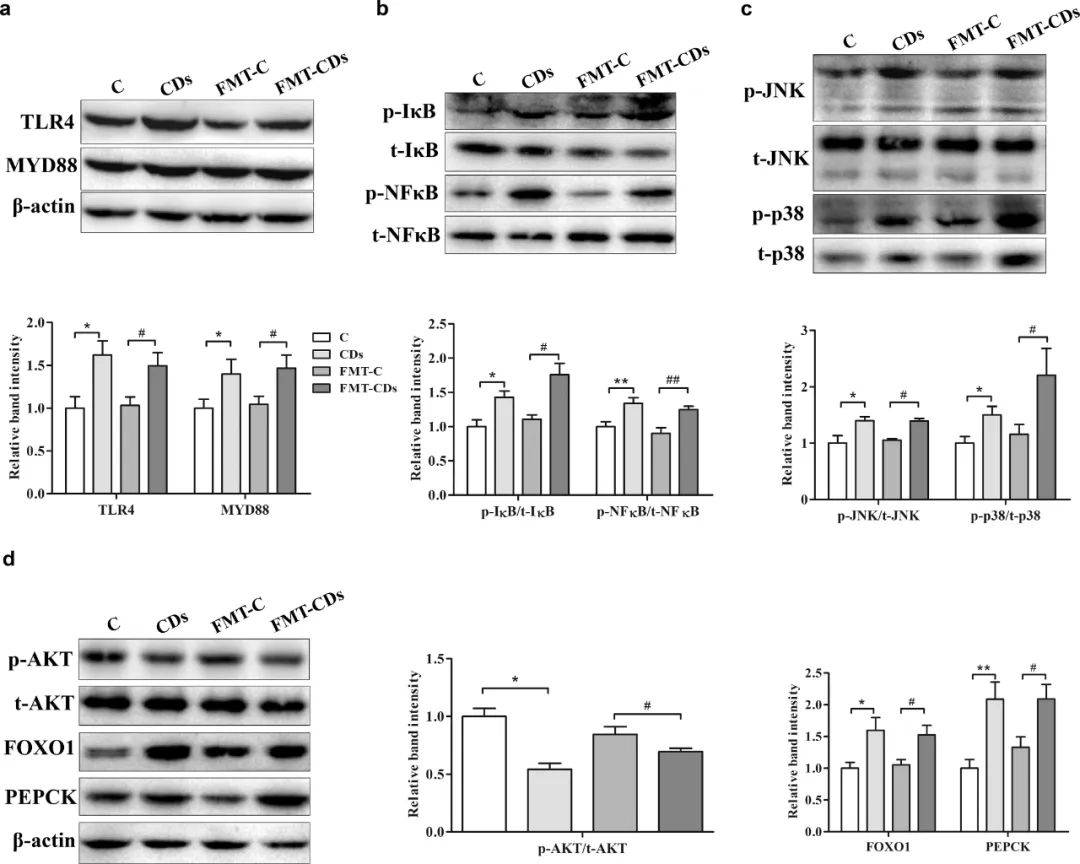
图7. CDs暴露小鼠的粪便菌群移植促进受体小鼠TLR4/NFκB/MAPK和胰岛素抵抗信号通路。
(a) TLR4/ MyD88信号通路的Western分析;(b) NF-κB信号通路的Western分析;(c) p38 MAPK信号通路的Western分析;(d)葡萄糖代谢相关蛋白的Western分析。*p < 0.05 vs C组,**p < 0.01 vs C组,#p < 0.05 vs FMT-C组,##p < 0.01 vs FMT-C组。结果为平均值±SE (n = 8)。
7抗生素消除了CDs诱导的肠道微生物介导的炎症和胰岛素抵抗
无菌小鼠或微生物耗尽小鼠已被证明能够降低饮食诱导代谢综合征的易感性,这表明肠道微生物的参与。有证据表明,混合抗生素(ABX)治疗(氨苄西林1 mg/mL,万古霉素0.5 mg/mL,新霉素1 mg/mL,甲硝唑1 mg/mL)可以消除95%以上的肠道细菌。因此,我们建立了抗生素治疗小鼠模型,进一步阐明了CDs对葡萄糖代谢的影响,并全面揭示了肠道菌群的驱动作用。抗生素能有效消除CDs引起的糖代谢障碍和肝脏损伤(补充图5a-l)。此外,抗生素对CDs诱导的结肠黏液层损伤和炎症的预防作用抑制了LPS介导的肝脏分子通路的改变(补充图5m-s和补充图6)。总体而言,本研究揭示了小鼠肠道菌群失调在CDs诱导的胰岛素抵抗中起着主要的调节作用。
结论
2型糖尿病是一种严重的疾病,尤其是在发展中国家。最近的报道表明,饮食引起的2型糖尿病与肠黏液层、肠道微生物以及它们之间的相互作用密切相关。本研究表明,长期口服食源性CDs能够诱导肠道菌群失调和肠道屏障的破坏,进一步导致系统炎症和葡萄糖代谢紊乱,但这可通过益生菌的保护作用得以恢复。此外,这些结果支持了改善肠道菌群是治疗饮食引起的2型糖尿病的潜在策略的可能性。
本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:guikequan@hmkx.cn)
本文来自投稿,不代表长河网立场,转载请注明出处: http://www.changhe99.com/a/3469gEQDwp.html

